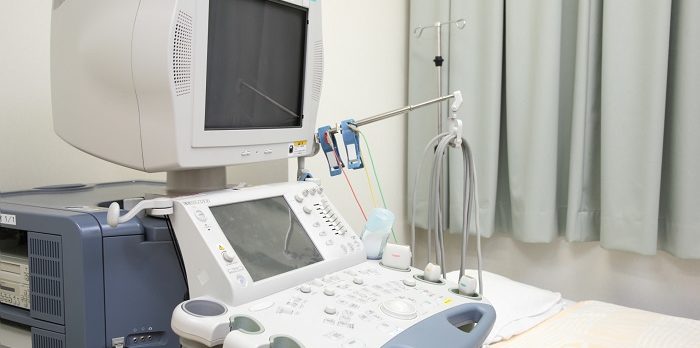
2022年9月1日に、潜在的適用リスククラス2aの滅菌医療機器及びそれ以上のリスククラスのすべての医療機器の生産に対して品質マネジメントシステム(QMS)の実装の必要性を定めた2022年2月9日付ロシア連邦政府命令No.135並びにNo.136が施行しました。リスククラス2aの非滅菌医療機器並びにリスククラス1の医療機器の生産に対するQMSは推奨されてはいますが、実装と監査は必須ではありません。
法令No.136によると、リスククラ2aの滅菌医療機器、リスククラス2bおよび3の医療機器の登録をするために、生産に対するQMSの実装が必須で、臨時監査を受ける必要があります。しかしながら、法令No.135によって、施行後9ヶ月間は監査なしで登録をすることが認められています。つまり、2023年6月1日までは、高リスクの医療機器もQMS規格への適合性監査を経ることなく登録をすることが可能なのです。
2022年9月1日から2023年6月1日までに登録ファイルへの文書への変更がされる、登録済み医療機器の生産は、登録後2年以内にISO134855の適合性に対する監査を受ける必要があります。
2023年6月1日から、高リスクの医療機器を新たに登録する場合、工場監査は必須です。さらに、登録ファイルに変更を加える場合は、そのような変更を加えた後2年以内に、QMS大使絵がISO13485に適合していることを確認するための監査を受けなければなりません。